|
De l'ECG à l'ANI : principe du calcul
L’analyse de la variabilité de la fréquence cardiaque (VFC) est une méthode reconnue de mesure de la régulation du système cardiovasculaire par le système nerveux autonome (SNA).
Les fluctuations « à court terme » du rythme cardiaque sont le reflet de l’activité des systèmes sympathique et parasympathique (paraS).
La modulation de fréquence cardiaque instantanée induite par les effets opposés des systèmes sympathique et paraS est mesurable par analyse spectrale : la composante hautes fréquences (HF) [0.15 – 0.4 Hz] est liée au système paraS uniquement, tandis que la composante basses fréquences (LF) [0.05 – 0.15 Hz] est sous l’influence des systèmes sympathique et paraS ; la thermorégulation et le baroréflexe influencent les LF et les très basses fréquences [0.004 – 0.05 Hz]. Les mouvements respiratoires représentent une part majeure de la modulation HF du rythme cardiaque, dont les effets sur le rythme cardiaque sont décrits comme « l’Arythmie Sinusale Respiratoire » : le rythme cardiaque accélère transitoiremet à chaque inspiration sous l’effet de la levée temporaire du tonus paraS.
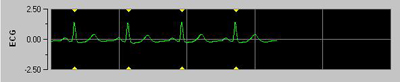
Figure 1 : sous-fenêtre inférieure sur l’affichage du moniteur PhysioDoloris. Des triangles jaunes apparaissent en regard de chaque pic R détecté (sur PhysioDoloris seulement).
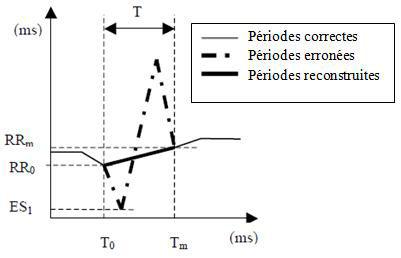
La détection de l’onde R du signal ECG (figure 1) permet de calculer avec précision l’intervalle de temps entre chaque contraction cardiaque (intervalle RR) exprimé en msec. Les séries RR sont filtrées en temps réel grâce à un algorithme de détection afin d’empêcher d’éventuels artéfacts d’interférer avec le calcul de la série RR : les ondes R erronées sont remplacées par une onde R théorique calculée par interpolation linéaire (figure 2) afin d’obtenir les calculs les plus fiables possibles (figures 3 et 4).
Figure 2 : principe de correction des artéfacts grâce à l’algorithme de détection.
Les intervalles RR représentent la période cardiaque instantanée dans son évolution au cours du temps.
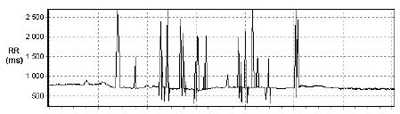
Figure 3 : série RR avant correction des artéfacts.
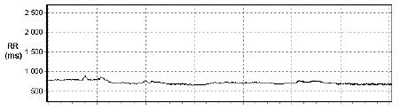
Figure 4 : série RR filtrée.
Chaque série RR est ensuite ré-échantillonnée à 8 Hz, puis isolée dans une fenêtre temporelle de 64 secondes. Afin de supprimer l’influence de la fréquence cardiaque de base du patient, la valeur moyenne M des intervalles RR de la fenêtre est soustraite à chaque échantillon : RRi = (RRi – M).
Afin de rendre les séries RR comparables entre elles, la série RR (RRi) - considérée comme un vecteur de 512 points - est ensuite normalisée en utilisant sa norme vectorielle S.
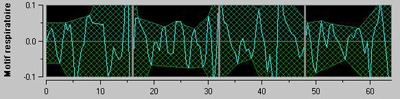
De nombreuses études ont montré que la douleur et/ou l’anxiété entrainent une activation sympathique mesurable par VFC sous la forme d’une augmentation du contenu spectral LF (sympathique et paraS) et d’une diminution du contenu spectral HF (paraS). Le filtrage de la série RR dans la bande de fréquence [0.15-0.5 Hz] permet donc d’afficher (figure 5) la surface d’influence de la ventilation dans la série RR, qui correspond au tonus paraS relatif du patient.
Figure 5 : sous-fenêtre intermédiaire sur l’affichage du moniteur PhysioDoloris. La surface hachurée représente l’activité quasi instantanée du tonus paraS relatif.
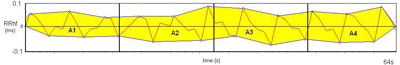
Afin d’être indépendant des variations de fréquence ventilatoire, notre index repose sur la mesure des surfaces de la série RR : détection automatique des maxima et minima, délimitation des contours des enveloppes supérieure et inférieure, et calcul des surfaces A1, A2, A3 et A4 entre les enveloppes supérieure et inférieure dans 4 sous fenêtres de 16 secondes (figure 6).
Figure 6 : calcul des surfaces A1, A2, A3 et A4 de la série RR.
On définit AUCmin (Area Under the Curve minimale) comme la plus petite parmi les quatre surfaces A1, A2, A3 et A4. L’Analgesia Nociception Index (ANI) est alors calculé afin d’exprimer une fraction de la surface d’influence de ventilation et fournir une valeur entre 0 et 100 :
ANI = 100 * [α*AUCmin+β] / 12,8
où α = 5,1 et β = 1,2 ont été déterminés afin de conserver l’adéquation entre l’effet visuel de l’influence de la respiration sur la série RR et l’index ANI.
L’ANI est équivalent au contenu spectral HF normalisé (HFnu) dans la littérature.
La surface totale maximale possible (égale à 12.8 correspondant à longueur*largeur de la figure 6 soit 64*0.2) qui sert de référence pour l'ANI, s'explique par le fait que les séries normalisées sont affichées dans une fenêtre dont l'axe des ordonnées est fixé grâce à la normalisation.
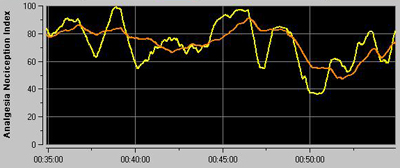
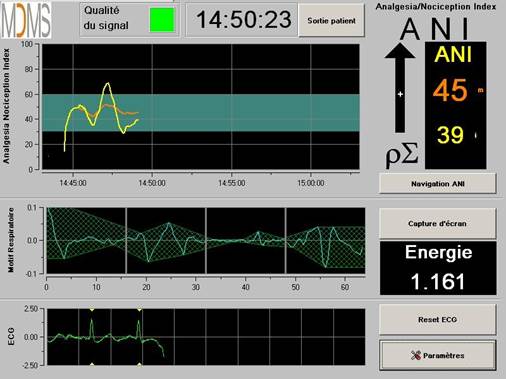
Le moyennage du signal ANI se fait sur deux fenêtres glissantes, l’une d’une minute pour l’ANIi instantané (courbe jaune) et l’autre de quatre minutes pour ANIm moyenné (courbe orange). Les deux courbes sont affichées dans la fenêtre supérieure sur l’écran du moniteur PhysioDoloris (figure 7) et leurs valeurs numériques respectives sont affichées en temps réel sur leur droite (figure 9).
Figure 7 : courbes ANIi et ANIm sur l’affichage supérieur du moniteur PhysioDoloris.
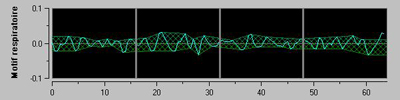
Une stimulation nociceptive aigue entraine un aplatissement quasi instantané de la série RR (figure 8) sous l’effet de la diminution rapide du tonus paraS, mais cette variation n’est reflétée qu’avec retard par l’ANIi dû aux calculs (20 à 30 secondes).
Figure 8 : aplatissement de la série RR filtrée traduisant une diminution du tonus paraS.
Les données cliniques préliminaires ont montré que l’ANI permet d’anticiper d’environ 10 min la réactivité hémodynamique utilisée en pratique clinique au cours de l’anesthésie générale.
Figure 9 : affichage du moniteur PhysioDoloris pendant un monitorage
Les limites du monitorage ANI sont essentiellement liées au caractère obligatoirement sinusal du rythme cardiaque et au recueil d’un signal ECG de bonne qualité. L’influence des différentes thérapeutiques utilisées au cours de l’anesthésie reste à déterminer. En particulier, l’interprétation de l’ANI en cas d’administration de médicaments anticholinergiques doit être extrêmement prudente pendant toute la durée de leur effet sur le nœud sinusal. A contrario, les médicaments beta bloquants ne semblent pas avoir une influence majeure sur l’ANI, mais leur effet sur le seuil prédictif de réactivité hémodynamique nécessite d’être déterminé.
L’utilisateur de ce monitorage doit être vigilant concernant l’interprétation physiologique de l’information affichée par le moniteur : un ANI proche de 100 correspond à un tonus paraS prédominant, c'est-à-dire à un patient « confortable ». A l’inverse, un ANI bas, inférieur à 50, voire proche de 0, correspond à un tonus paraS abaissé, ce qui correspond à une probabilité élevée de réactivité hémodynamique à court terme (10 minutes environ) si l’anesthésie et l’intensité du stimulus chirurgical demeurent constantes.